Постепенно в нашем блоге мы продвигаемся к обсуждению диаграммы «железо-углерод». В этой статье рассмотрим примеры основных диаграмм фазового равновесия.
Диаграммы фазового равновесия строят на основании кривых охлаждения, руководствуюсь правилом фаз. Правило фаз выглядит так:
P+F=C+2
Здесь P – это максимальное число фаз, которые могут существовать в системе. Фаза – однородная часть системы, которая имеет поверхность раздела.
F – число степеней свободы. Степень свободы – регулируемы извне условия, которые независимы и определяют состояние системы (температура, давление, состав).
C – наименьшее число веществ, состав которых не может быть изменен. Именно эти вещества и определяют систему.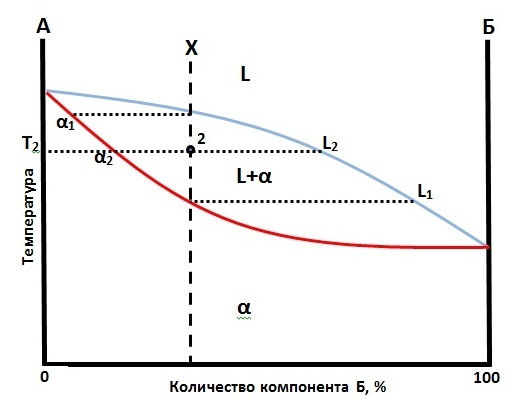
Начнем с самого простого случая – диаграмма фазового превращения двух элементов, имеющих неограниченную взаимную растворимость в твердом состоянии. Пример такой диаграммы показан на рисунке.
По оси ординат откладывают температуру, по оси абсцисс процент вещества (увеличение процента вещества Б уменьшает количества вещества А на то же процент). В верхней части буквой L обозначена жидкая фаза. α – твердый раствор образованный веществами А и Б. Синяя линия – это линия ликвидуса, после пересечения которой при нагреве в растворе остается только жидкая фаза, а при пересечении ее при охлаждении появляются первые кристаллы твердой фазы (здесь это α – фаза). Красная линия – это линия солидуса, после ее пересечения при нагреве появляются первые участки жидкого вещества, а после ее пересечении ее во время охлаждения в системе остается только твердый раствор (в данном случае α – фаза).
Между линиями солидуса и ликвидуса находятся одновременно и жидкая и твердая фаза (L+α).
Если рассмотреть охлаждение сплава состава X, то при пересечении линии ликвидуса первыми выделяются кристаллы α – фазы состава α1. В точке 2 составу α – фазы будет соответствовать точка α2, а L – фазе точка L2. Количество этих фаз в системе в точке 2 определяют по правилу рычага:
Количество α - фазы в точке 2=(отрезок 2-L2)/(отрезок α2-L2)
А время нагрева сплава состава X при пересечении линии солидуса появляется жидкость состава L1.
Применим правило фаз для двухкомпонентной системы L+α. Так как эти две фазы соприкасаются, то они должны находиться при одинаковом давлении и температуре. Но одинаковый химический состав они иметь не обязаны. Правило фаз требует, чтобы двухфазная смесь в системе из двух компонентов имела две степени свободы:
P+F=C+2,
2+2=2+2
Если принять давление постоянным, а в качестве одной оставшейся степени свободы использовать температуру (температура Т2 на рисунке), то состав фаз автоматически будет определен. А именно α2 и L2 для α и L фаз соответственно.
Другие примеры диаграмм рассмотрим во второй части этой статьи.
